B12-vitamin: tények, félreértések és gyakorlati információk
A B12-vitamin egyike azoknak a mikrotápanyagoknak, amelyek nélkül az emberi szervezet egyszerűen nem tud működni. Mégis, sokszor csak akkor kerül szóba, amikor valaki fáradtságról, memóriazavarról vagy vérszegénységről panaszkodik. A B12 ugyanis kulcsszerepet játszik az idegrendszer egészségében, a vérképzésben, a DNS-szintézisben és a sejtjeink energiaellátásában.
A helyzetet bonyolítja, hogy a B12-hiány nem csupán étrendi kérdés: nem elég megnézni, ki eszik húst és ki nem. A vitamin felszívódása egy rendkívül összetett folyamat, amelyhez szükség van gyomorsavra, speciális szállítófehérjékre, egészséges bélműködésre és megfelelő genetikai háttérre is. Ha bármelyik láncszem sérül, hiány alakulhat ki – még akkor is, ha az étrend elvileg elegendő B12-t tartalmaz.

Ezért a B12-vitamin története nem csak egy „egyetlen vitaminról” szól, hanem arról is, hogy mennyire összekapcsolódik az emésztőrendszerünk, a vérünk, a génjeink és az életmódunk működése. A következő cikkben bemutatjuk, hogyan alakulhat ki B12-vitiamin hiány, milyen tényezők állhatnak mögötte, és miért fontos idejében felismerni és kezelni.
A B12-vitamin szerepe az emberi szervezetben
Ahogy fent is írtuk, a B12-vitamin rengeteg élettani folyamathoz elengedhetetlen. Nézzük meg részletesen, hogy mit is csinál az egyes fiziológiai folyamatokban ez a mikrotápanyag.
A B12-vitamin idegrendszeri hatásai
A B12-vitamin nélkülözhetetlen az idegrendszer egészséges működéséhez, mivel alapvető szerepe van a metilációban, a neurotranszmitter-anyagcserében, a DNS-szintézisben és a mielinhüvely fenntartásában. Hiánya visszafordíthatatlan neurológiai károsodáshoz vezethet, ezért a szintje kritikus tényező mind a kognitív, mind a pszichiátriai egészség szempontjából.
Metiláció és neurotranszmitter-szintézis
A metiláció a szervezetünkben zajló egyik „alapművelet”, egyfajta biokémiai kapcsoló. Lényege, hogy egy apró „metilcsoportnak” nevezett molekularész (egy szénatom három hidrogénnel: –CH₃) hozzákapcsolódik más molekulákhoz – például vitaminokhoz, hormonokhoz, fehérjékhez vagy akár a DNS-hez.
Ez olyan, mintha a szervezet kis címkéket ragasztana dolgokra:
- néha bekapcsol egy folyamatot,
- máskor kikapcsol,
- vagy éppen átalakít valamit, hogy működőképes legyen.
Metilációs ciklusok (2)
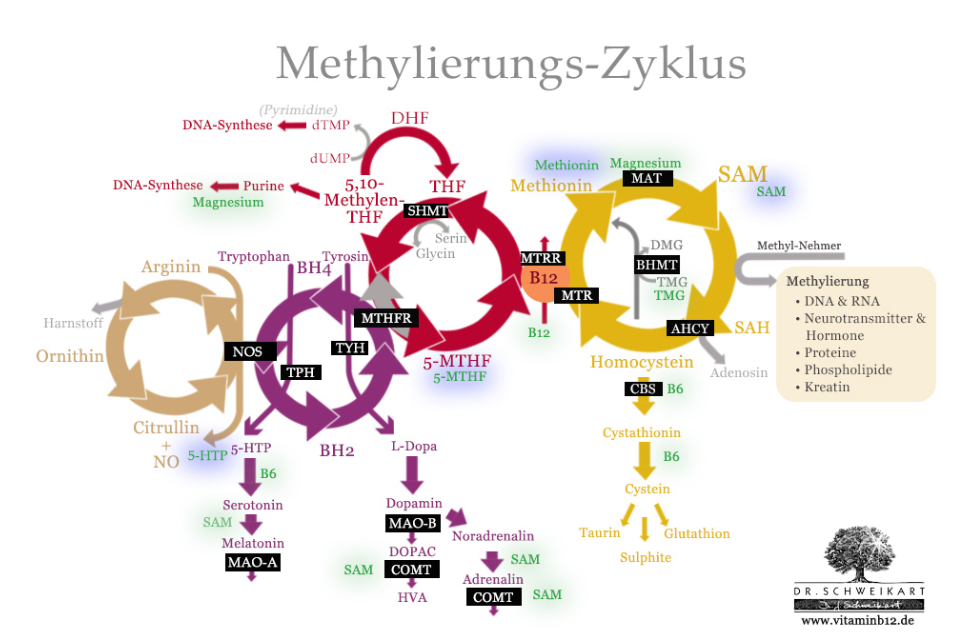
Az idegrendszer működése szempontjából ez egy nagyon fontos folyamat, mert erre van szükség a lelki és testi jólétünket is biztosító kommunikációs anyagok (neurotranszmitterek) előállításához. Ilyen idegsejtek közötti kommunikációs anyagok vagy ingerület átvivő anyagok a dopamin, a szerotonin, a noradrenalin – ezek nem tudnának létrejönni a metiláció nélkül.
Na de hogy jön ide a B12-vitamin?
A metilációs folyamatokat úgy kell elképzelni, mintha sok fogaskerék együttesen dolgozna egy gépezet megfelelő működésében. Minden fognak a fogaskeréken fontos szerepe van, és ha bármelyik hiányzik vagy megsérül, akkor a gépezet nem tud megfelelően működni. Ebben a fogaskerékben sok ponton a B12-vitamin az egyik fog.
Ahhoz, hogy a dopamin, a szerotonin, a noradrenalin létre tudjon jönni, és támogatni tudja az idegrendszerünket, ahhoz szükség van egy enzimre (S-adenozil-metionin (SAM)), ami viszont csak a B12-vitaminnal együtt tud megfelelően létrejönni és működni (1).
Myelinhüvely képződése és fenntartása
Ahhoz, hogy az idegsejtek gyorsan tudják közvetíteni az információkat, ahhoz egy zsírokban és kollagénban gazdag szigetelő rétegre van szükségük – ez a myelin hüvely. A B12-hiány hibás myelin hüvely szintézishez vezethet (3), mert ilyenkor felhalmozódik egy anyag (metilmalonsav (MMA)), ami toxikus a myelin hüvelyre és így az idegsejtekre is. Következmény: demielinizáció, perifériás neuropátia, gerincvelői károsodások (4).
Neuroprotektív hatás és DNS-javítás
A B12-vitamin a DNS-szintézis egyik kulcseleme a B9-vitaminnal együttműködve (5 ). Megfelelő B12-vitamin szint nélkül a gyorsan osztódó sejtek (pl. idegrendszeri gliasejtek) működése károsodik.
B12- és B9-vitamin szerepe a DNS-szintézisben
A B12-vitamin olyan, mint egy kulcs, ami elindít egy fontos „gyártósort” a szervezetben. Ez a gyártósor többek között új sejtek építéséhez kell (pl. a vérsejtekhez vagy az idegsejtekhez).
A sejtek minden osztódáskor új DNS-t építenek fel az eredeti másolataként, ehhez pedig metilcsoportok folyamatos áramlására van szükség.
Mi történik B12-hiányban? Ha nincs B12, akkor a speciális enzim működése leáll:
- a folsav beszorul egy olyan formába (metil-folát), amit nem tud a szervezet a DNS-építéshez felhasználni → olyan, mintha a tégla ott lenne, de nem lehetne beépíteni a házba.
- emiatt nem tudnak normálisan osztódni a sejtek, különösen a vérsejtek.
Metilációs ciklusok (2)
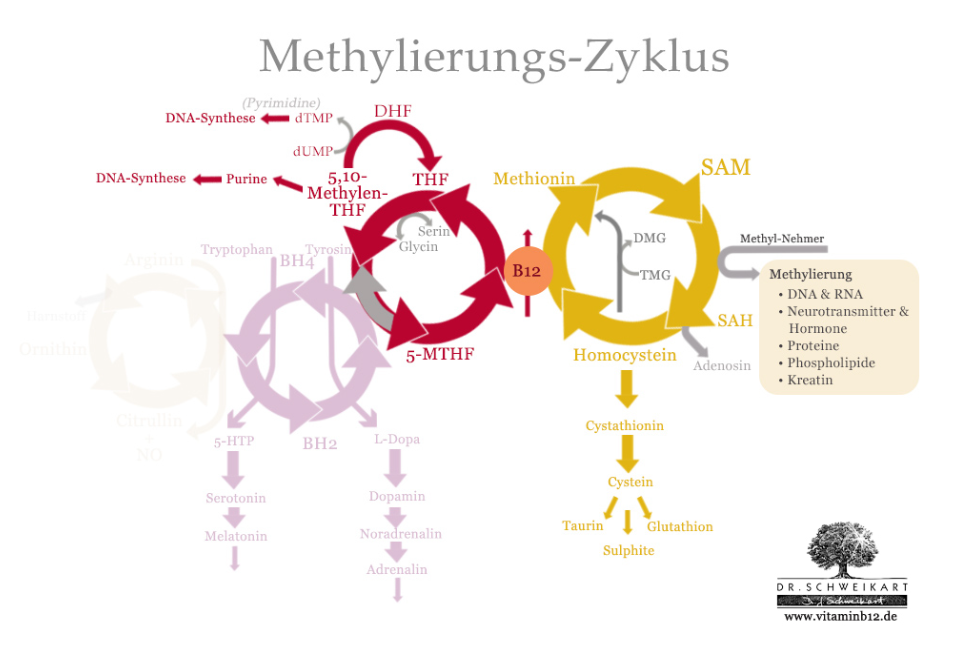
Hogyan működik ez a rendszer?
- Van egy anyagunk, a homocisztein (aminosav-származék), amit át kell alakítani egy másik anyaggá, a metioninná (aminosav).
- Ehhez kell egy speciális enzim, ami viszont csak akkor működik, ha megkapja a megfelelő kulcsot – ez a B12-vitamin.
Eközben egy másik vitamin, a folsav (B9-vitamin) is részt vesz a folyamatban: „odaad” egy metilcsoportot, majd visszaalakul a saját működő formájába, hogy a DNS-építésben részt vehessen.
Mi történik B12-vitamin hiányában? Ha nincs B12-vitamin, akkor a speciális enzim működése leáll:
- a folsav beszorul egy olyan formába (metil-folát), amit nem tud a szervezet a DNS-építéshez felhasználni → olyan, mintha a tégla ott lenne, de nem lehetne beépíteni a házba.
- emiatt nem tudnak normálisan osztódni a sejtek, különösen a vérsejtek.
Mi történik B12- és B9-vitamin hiány esetén a vörösvértestek képződése szempontból? (6)
A vérünkben keringő vörösvértestek (eritrociták) oxigént szállítanak a szervezet minden pontjába. Ezek a sejtek a csontvelőben képződnek, és folyamatosan pótlódniuk kell, mert átlagosan 120 nap után elpusztulnak.
Ahhoz, hogy a csontvelőben új, egészséges vörösvértestek szülessenek, a sejteknek osztódniuk kell. Az osztódáshoz viszont DNS-t kell másolniuk – és itt jön képbe a B12- és B9-vitamin.
DNS-szintézis lelassul, a sejtosztódás gátlás alá kerül
- A vörösvértest-előalakok a csontvelőben nem tudnak rendesen osztódni.
- Az RNS és fehérjeszintézis viszont folytatódik → a sejtek nőnek, de nem osztódnak.
Következmény: megaloblastos vérképzés
- A csontvelőben óriási, éretlen sejtmagú előalakok jelennek meg (megaloblasztok).
- A véráramban makrociták (nagy vörösvértestek) jelennek meg.
A megaloblasztos, azaz nagysejtes vérszegénység (anémia) jelei a vérképen:
- alacsony hemoglobin szint,
- emelkedett MCV (átlagos vörösvértest-térfogat) érték,
- alacsony retikulocitaszám,
- gyakran emelkedett LDH és indirekt bilirubin (a csontvelőben széteső sejtek miatt) érték
A nagysejtes vérszegénység elsődleges tünetek:
- fáradtság
- gyengeség
- sápadtság
- terhelésre nehézlégzés
Ha csak a B12-vitamin hiányzik, annak mások lesznek a tünetei:
Neurológiai tünetek (paresthesia, memóriazavar, járászavar, demencia-szerű kép). Ez nem alakul ki folát-hiány esetén! Ezért veszélyes csak folsavat (B9-vitamin) pótolni B12-hiányban: a vérkép rendeződhet, de az idegrendszeri károsodás súlyosbodhat!
A B12-vitamin formái – melyik mire jó?

A B12-vitamin, kobalamin, többféle formában létezik, és nem mindegy, hogy melyikkel találkozik a szervezetünk. Bár mindegyik kobalamin-származék, különböző módon működnek, és nem egyformán hasznosulnak.
- Cianokobalamin
- Hidroxokobalamin
- Metilkobalamin
- Adenozilkobalamin
Egyes szakirodalmak arra hivatkoznak, hogy bármelyik forma jó lehet, és teljesen mindegy, melyik formát használjuk, mivel a sejt úgy is lecsupaszítja a kobalaminhoz csatlakozó oldalcsoportot. Mi az igazság?
Hogyan használja fel a szervezet a B12-vitamint?
Amikor a B12-vitamin bejut a sejtekbe, a különböző kémiai „oldalcsoportokat” (metil-, adenozil-, hidroxo-, ciano-) a sejtek speciális fehérjéi leválasztják (7). A B12-vitamin így egy „köztes” formává alakul, és ebből építi fel a szervezet azt a két aktív formát, amely ténylegesen részt vesz az anyagcserében:
- Metilkobalamin – a sejt citoplazmájában működő enzimet segíti, amely nélkülözhetetlen a DNS megfelelő szintéziséhez (8).
- Adenozilkobalamin – a mitokondriumokban működő enzim kofaktora, amely kulcsszerepet játszik az energiatermelésben és a zsírsavak lebontásában 9).
Ez alapján tehát úgy tűnhet: mindegy, milyen formát veszünk be, hiszen a szervezet úgyis átépíti. A valóság azonban árnyaltabb.
Mit jelent ez a gyakorlatban?
Cianokobalamin
- Szintetikus forma, stabil és olcsó, ezért sok multivitaminban ezt használják (10).
A sejtnek először le kell választania róla a cianid-csoportot. Ez kis mennyiségben nem jelent veszélyt, de a folyamat többletterhelést ró a szervezetre. - Általában ételből több cianid-csoportot juttatunk be, így nem valószín, hogy tuladagoljuk. Ennek ellenére mégiscsak jobb, ha nem terheljük vele a szervezetet.
- A cianid-csoportot később nem tudjuk felhasználni, így előnnyel nem jár a szervezet számára.
Rejt-e veszélyt a cianokobalamin fogyasztása? Kialakulhat-e ciánmérgezés?
A cianokobalamin egy szintetikus B12 forma, ahol a kobalamin központi kobaltatomjához cianid-ion (–CN) kapcsolódik.
Amikor a sejtek feldolgozzák a B12-t, a cianid-csoport leválik. Ez a felszabaduló cianid mennyiség nagyon kicsi, nagyságrendekkel kevesebb, mint ami toxikus lenne az ember számára.
Egészséges embereknél a szervezet több mechanizmussal is képes a ciánt méregteleníteni (pl. a rodanáz enzim tiocianáttá alakítja, ami vizelettel kiürül).
Speciális állapotokban azonban okozhat valódi veszélyt:
- Vesebetegeknél vagy detoxikációs zavarban (pl. tiol-anyagcsere zavarok) a szervezet kevésbé tudja hatékonyan lebontani a ciánt.
Emiatt használjunk inkább a hidroxo-, metil- vagy adenozilkobalamint formát!
Hidroxokobalamin
- Természetesebb forma, amely jól kering a vérben és hosszabban megmarad a szervezetben (11).
- Könnyen átalakítható metil- és adenozilkobalaminná.
- Injekciós készítményekben gyakran ezt alkalmazzák, mert stabil és jól hasznosul.
Metilkobalamin
- A leválasztott metil oldalcsoport közvetlenül metil-donorként hasznosítható (12).
Bizonyos genetikai mutációk esetén (pl. MTHFR) előnyt jelenthet - Különösen hasznos lehet idegrendszeri problémák és metilációs zavarok esetén.
Adenozilkobalamin
- Az adenozilcsoport (egy adenozin nukleotid-származék, ami a genetikai állományunkat is (pl. DNS-t) építi) lehasad, és nukleotid anyagcserébe kerülhet.
- Ezt az adenozil oldalláncot vissza tudja a mitokondriumban építeni a szervezet a kobalamin alaphoz – így használata kifejezetten hasznos a megfelelő anyagcseréhez.
- Különösen előnyös lehet energia-anyagcsere zavarokban, mitokondriális betegségekben, krónikus fáradtságban (13).
A B12-vitamin étrendi forrásai
A B12-vitamin egyedülálló abban, hogy természetes, biológiailag aktív formában kizárólag állati eredetű élelmiszerekben fordul elő. Ennek oka, hogy a B12-vitamint nem növények vagy állatok termelik, hanem bizonyos baktériumok. Az állatok bélrendszerében élő mikroorganizmusok képesek előállítani, ezért jelenik meg a húsban, halban, tojásban és tejtermékekben.
Fő források
- Húsok (marha, csirke, sertés, máj különösen gazdag forrás)
- Halak és tenger gyümölcsei (lazac, tonhal, makréla, kagyló)
- Tojás
- Tej és tejtermékek (sajt, joghurt, tej)
Mi a helyzet a növényi B12-vel?
- A növények nem tartalmaznak valódi, aktív B12-vitamint, mert nem képesek előállítani.
Egyes algákban és fermentált élelmiszerekben (pl. spirulina, chlorella, kombucha, szójaszósz) találhatók B12-analógok („ál-B12”, úgynevezett pszeudovitamin-B12-t más néven adenin-bázisú kobalamin-analógot), amelyek szerkezetileg hasonlítanak a valódi vitaminra, de az emberi szervezet nem tudja őket hasznosítani. Sőt, bizonyos esetekben még gátolhatják is a valódi B12-vitamin működését a laborvizsgálatok félrevezetésével.

Miért probléma az ál B12?
- A pszeudovitamin-B12 nem aktiválja a B12-függő enzimeketl:
- Az ál B12 versenyez a valódi B12-vel a felszívódási útvonalakon, ezzel rontva a valódi B12-vitamin felszívódásának a lehetőségét (14)
A pszeudovitamin B12 legfontosabb forrásai:
- Spirulina (Arthrospira platensis) – szinte kizárólag pszeudovitamin-B12-t tartalmaz (15)
- Chlorella – vegyesen tartalmazhat aktív és inaktív formákat
- Nori (szárított tengeri alga) – előfordulhat benne kis mennyiségű aktív B12, de nem megbízható forrás (16)
- Fermentált növényi termékek (pl. tempeh, miso) – elhanyagolható mennyiség, gyakran inaktív formában
Hogyan szívódik fel a B12-vitamin a szervezetben?
A B12-vitamin felszívódása olyan, mint egy váltófutás: több „csapattag” adogatja egymásnak, amíg végül célba ér, és eljut a sejtekhez. Ez a folyamat több lépcsőből áll, emiatt sajnos több területen is felléphet probléma a felszívódásban.
Szájüreg – haptokorrin
Már a szájban, a nyálmirigyek által termelt haptokorrin (R-fehérje, transcobalamin I) találkozik a B12-vitaminnal.
- Ez a fehérje azonnal megköti és védi a B12-t a gyomor erősen savas közegétől.
Ezért, ha valakinek kevés a nyála (pl. Sjögren-szindróma, sugárkezelés után), már itt csökkenhet a B12-vitamin védelme.
Gyomor – gyomorsav és intrinzik faktor
A gyomorsav és az intrinsic faktor ugyanabban a sejttípusban, a parietális sejtekben képződik. A gyomorsav biztosítja, hogy a táplálékból felszabaduljon a B12-vitamin, az intrinsic faktor pedig lehetővé teszi annak aktív felszívódását a vékonybélben.
- A gyomorban a sósav (HCl) és a pepszin nevű az emésztőenzim leválasztja a B12-vitamint az ételben lévő fehérjékről.
- Az intrinsic faktort (IF) egy speciális fehérje, amely nélkülözhetetlen a B12-vitamin későbbi felszívódásához a vékonybélben.
- Ebben a savas közegben a B12 szinte teljesen a nyálból származó haptokorrinhoz kötve kering tovább.
Ha valamilyen oknál fogva ezek a parietális vagy fedő sejtek nem működnek megfelelően, akkor a B12-vitamin felszívódás nagy mértékben sérül.
Milyen problémák okozhatják a parietális sejtek károsodását?
- Autoimmun gastritis – a szervezet saját immunrendszere támadja a parietális sejteket.
- Helicobacter pylori fertőzés – krónikus gyomorhurutot okozhat, amely károsítja a parietális sejteket.
- Gyomor-műtétek (pl. gyomorreszekció, bypass) – a gyomor egy részének eltávolítása csökkenti a parietális sejtek számát.
- Krónikus atrophiás gastritis – Időskorban vagy tartós irritáció miatt a gyomornyálkahártya elvékonyodik, a parietális sejtek pusztulnak.
- Gyógyszerek
- Protonpumpa-gátlók (PPI), H2-receptor blokkolók → gátolják a gyomorsavtermelést, közvetve a B12 felszívódását is rontják.
- Metformin (cukorbetegségben gyakran használt szer) → gátolhatja a B12 felszívódását az ileumban.
- Alkoholfogyasztás, dohányzás – hosszú távon irritálják a gyomor nyálkahártyáját, elősegítik a sejtpusztulást.
- Genetikai okok (ritka) – Pl. intrinsic faktor hiánya veleszületetten.
Vékonybél – patkóbél – haptokorrin → intrinsic faktor csere
- Amikor a B12–haptokorrin komplex eljut a patkóbélbe (duodenum), a hasnyálmirigy enzimei (pl. tripszin) lebontják a haptokorrint.
- Ekkor a B12 felszabadul, és először szabad formában van jelen a vékonybélben (17 V).
- A gyomor parietális (fedő) sejtjei által már korábban kiválasztott intrinsic faktor a patkóbélben kötődik meg a felszabadult B12-höz.
Vékonybél – csípőbél – az átjutás
- A B12–intrinsic faktor komplex rendkívül stabil, és ez az egyetlen forma, amely képes a bélhámsejtek felszínén található receptorokon keresztül felszívódni.
- Ez a folyamat a csípőbél (ileum) terminális szakaszában zajlik le, a cubilin nevű receptor segítségével (18 V).
Ez a váltás kritikus lépés: ha nincs elegendő hasnyálmirigy-enzim, a haptokorrin nem bomlik le → a B12 nem tud IF-hez kapcsolódni → nem szívódik fel.
Ha az ileum beteg (pl. Crohn-betegség, műtéti eltávolítás), a B12-felszívódás súlyosan károsodik.
Véráram – szállítás a sejtekhez
A bélsejtből kijutó B12-vitamin a vérben a transzkobalamin II nevű fehérjéhez kapcsolódik.
Ez egy szállító fehérje a véráramban, amely eljuttatja a B12-t a sejtekhez.
A bélflóra és a B12-vitamin kapcsolata
Mennyi B12 juthat le a vastagbélbe?
- A B12 felszívódása az ileumban (csípőbél, a vékonybél utolsó szakasza) történik, intrinsic faktor (IF) segítségével.
- A csípőbélben általában nagyon hatékonyan felszívódik, így a vastagbélbe már csak minimális mennyiség jut le.
- Az étellel bevitt B12-vitamin mennyiségének nagy része tehát nem áll a vastagbél baktériumai rendelkezésére.
- Emiatt a bélflóra versenyez a szűkös B12-forrásokért, ha egyáltalán hozzájut.
Mely baktériumok képesek B12-t termelni?
Bár az emberi vastagbélben is termelődik B12-vitamin, de itt már nem tudja felszívni a szervezet. Ezek a baktériumok és archeák tudják általában szintetizálni:
- Propionibacterium freudenreichii (pl. fermentált tejtermékekben)
- Lactobacillus reuteri (néhány törzse)
- Bacteroides fragilis és rokon fajok (bélben élnek, de általában a vastagbélben szintetizálnak)
- Akkermansia muciniphila – képes B12-dependens és B12-független anyagcserére is
- Egyes Clostridium fajok
- Methanosarcina (archea, nem baktérium)
Hogyan hat a B12 szint az egyes baktériumokra?
A B12-vitamin kofaktorként részt vesz több bakteriális anyagcsere-útvonalban (pl. propionát és butirát képzésben).
B12-hiány esetén:
- Akkermansia muciniphila – ha nincs elég B12-vitamin, inkább szukcinátot termel → ez nagy mennyiségben a gazdaszervezetben fokozhatja a gyulladásos folyamatokat. Ha van B12-vitamin, akkor inkább rövid szénláncú zsírsavakat termel, amelyek inkább kedvezőek a bélfal és az immunrendszer számára.
- Más baktériumoknál is hasonló a státusz – a B12-vitamin jelenléte többnyire energiahatékonyabb és a gazdaszervezet számára kedvezőbb fermentációs végtermékeket eredményez.
Mi okozhat B12-vitamin hiányt?

Étrend
- Vegán / vegetáriánus étrend – nem jut be egyáltalán B12-vitamin a szervezetbe
- Kevés hús, tojás, tejtermék fogyasztása – nem jut be elégséges mennyiségű B12-vitamin a szervezetbe
Növényi B12-vitamin túlzott fogyasztása – hazánkban nem reális hiányok – versenyzik a valódi B12-vitaminnal a felszívódáson
Gyomorral kapcsolatos okok
- Kevés gyomorsav (hypochlorhydria) – nem tud ételből kibontódni a B12-vitamin
- Intrinsic faktor hiánya – nem tud a vékonybélben felszívódó a B12-vitamin
- Gyomorműtétek (pl. gyomor bypass, részleges gyomorreszekció) – hiányoznak a gyomorsavat és az intrinzik faktort termelő sejtek.
Stressz és a vagális tónus kapcsolata
- A krónikus stressz tartósan aktiválja a szimpatikus idegrendszert („üss vagy fuss” üzemmód).
- Ilyenkor a paraszimpatikus idegrendszer, és azon belül a nervus vagus aktivitása háttérbe szorul.
- A vagális tónus gyengülése miatt romlik az emésztés: csökken a gyomorsavtermelés, enzimek és intrinsic faktor kiválasztás.
Gyógyszerek
- Gyomorsavcsökkentők: protonpumpa-gátlók, hisztamin receptor blokkolók – tartósan csökkentik a savszintet.
- Metformin (cukorbetegségben) – gátolja a B12-vitamin felszívódását a bélben.
- Antibiotikumok, fogamzásgátlók, epilepszia elleni szerek – megzavarhatják a bélflórát vagy a vitamin anyagcseréjét.
Bélrendszeri betegségek
- Crohn-betegség, colitis ulcerosa – gyulladás az ileumban (ahol a B12.vitamin felszívódik).
- Lisztérzékenység (cöliákia) – a vékonybél károsodása miatt romlik a vitaminok felszívódása.
- Bélbaktériumok túlnövekedése (SIBO) – a baktériumok felhasználják a B12-vitamint az ember helyett.
- Parazitafertőzés – eleszi a B12-vitamint a szervezet elől.
Genetikai tényezők
- MTHFR, MTR, MTRR, TCN2 variánsok – csökkent hatékonyságú B9- és B12-vitamin anyagcsere jellemző ilyenkor.
Életkor
- Időskorban gyakran csökken a gyomorsavtermelés és a parietális sejtek működése → gyakoribb a hiány.
Egyéb tényezők
- Alkoholfogyasztás – rontja a felszívódást, májban csökkenti a raktározást.
- Májbetegségek – a B12-vitamin jelentős része a májban raktározódik.
- Veseelégtelenség – megváltozott anyagcsere és fokozott veszteség.
- Terhesség, szoptatás – megnövekedett igény, könnyen kialakulhat hiány, ha nem elég a bevitel.
Milyen laborértékek mutatják meg a B12-vitamin szintjét a szervezetben?
Sokszor a vér B12-szintje nem mutatja meg a vitamin valódi hasznosulását a szervezetbe. Hogy több információval rendelkezzünk, a következő laborvizsgálatokat érdemes alkalmazni:
- B12-vitamin
- Holotranszkobalamin (holoTC) – a sejtekbe ténylegesen bejutó B12-vitamin formája.
- Homocisztein – szintje magas lesz B12-vitamin hiányban (de B9- és B6-vitamin hiányban is!)
- MCV – vörösvértest átlagos mérete (pajzsmirigy alulműködés esetén is lehet magas az érték!)
- Metilmalonsav (MMA) – B12-vitamin hiány esetén megemelkedik.
Mennyi B12-vitaminra van szükségünk naponta?
Ajánlott napi beviteli értékek (RDA – Recommended Dietary Allowance) (19)
- Felnőtteknek: 2,4 µg / nap
- Várandós nőknek: 2,6 µg / nap
- Szoptató nőknek: 2,8 µg / nap
- Serdülők (14–18 év): 2,4 µg / nap
- Gyermekek (9–13 év): 1,8 µg / nap
- Kisebb gyermekek (4–8 év): 1,2 µg / nap
- Csecsemők (0–12 hónap): 0,4–0,5 µg / nap
Hiány esetén a pótlás sokszor magas dózisú (500–1000 µg) készítményekkel történik.
Súlyos vagy felszívódási zavarban szenvedőknél injekciós forma szükséges.
B12-vitamin és terhesség
- A B12-vitamin és a folsav együtt segíti a magzat idegrendszeri fejlődését.
- Hiányuk növeli a velőcsőzáródási rendellenességek, koraszülés, alacsony születési súly kockázatát.
B12-vitamin és krónikus betegségek
- Szív-érrendszeri betegségek – B12 hiányban nő a homocisztein, ami érfalkárosító.
- Demencia, Alzheimer-kór – alacsony B12-szint fokozza a kockázatot.
- Depresszió, szorongás – gyakran társul alacsony B12- és folsav szinttel.
Túladagolható-e a B12-vitamin?
- Mivel vízoldékony, a felesleg általában kiürül.
- Nincsenek klasszikus túladagolási tünetek.
- Nagyon magas szintek esetén viszont felmerült összefüggés bizonyos májbetegségekkel és daganatokkal – ezek azonban inkább a háttérben zajló betegség következményei, nem a B12-vitamin „mérgező” hatásai.
Szerkesztette: Lányi Kata
- https://www.mdpi.com/2072-6643/15/12/2734?utm_source=chatgpt.com Vitamin B12—Multifaceted In Vivo Functions and In Vitro Applications by Krzysztof Halczuk,Julia Kaźmierczak-BarańskaORCID,Bolesław T. KarwowskiORCID,Aleksandra Karmańska andMarcin Cieślak *ORCID
- https://www.vitaminb12.de/methylierung-zyklus/
- https://pmc.ncbi.nlm.nih.gov/articles/PMC7551072/?utm_source=chatgpt.com B-vitaminok és egy szénatomos anyagcsere: következmények az emberi egészségre és betegségekre Peter Lyon 1,2, Victoria Strippoli 1,2, Byron Fang 1,2, Luisa Cimmino 1,2, Szerzői információk Cikk megjegyzések Szerzői jogi és licencinformációk PMCID: PMC7551072 PMID: 32961717
- https://en.wikipedia.org/wiki/Vitamin_B12_deficiency?utm_source=chatgpt.com
- https://pmc.ncbi.nlm.nih.gov/articles/PMC3257642/?utm_source=chatgpt.com B12-vitamin az egészségben és a betegségekben Fiona O’Leary 1, Samir Samman PMCID: PMC3257642 PMID: 22254022
- https://en.wikipedia.org/wiki/Vitamin_B12_deficiency?utm_source=chatgpt.com
- Nielsen MJ, Rasmussen MR, Andersen CB, Nexø E, Moestrup SK. Vitamin B12 transport from food to the body’s cells — a sophisticated, multistep pathway. Nat Rev Gastroenterol Hepatol. 2012;9(6):345–354
- Hannibal L, Lysne V, Bjørke-Monsen AL, et al. Biomarkers and algorithms for the diagnosis of vitamin B12 deficiency. Front Mol Biosci. 2016;3:27.
- Fedosov SN. Biochemical markers of vitamin B12 deficiency combined in one diagnostic parameter: the age-dependence and association with cognitive function and blood hemoglobin. Clin Chim Acta. 2013;422:47–53.
- O’Leary F, Samman S. Vitamin B12 in health and disease. Nutrients. 2010;2(3):299–316.
- Nielsen MJ, Rasmussen MR, Andersen CB, Nexø E, Moestrup SK. Vitamin B12 transport from food to the body’s cells — a sophisticated, multistep pathway. Nat Rev Gastroenterol Hepatol. 2012;9(6):345–354.
- Smith AD, Refsum H. Vitamin B12 and cognition in the elderly. Am J Clin Nutr. 2009;89(2):707S–711S.
- Fedosov SN. Biochemical markers of vitamin B12 deficiency combined in one diagnostic parameter: the age-dependence and association with cognitive function and blood hemoglobin. Clin Chim Acta. 2013;422:47–53.
- Watanabe F, Takenaka S, et al. (1999). Pseudovitamin B12 is the predominant cobamide in Spirulina. J Agric Food Chem. DOI: 10.1021/jf990541b
- Watanabe F, Takenaka S, et al. (1999). Pseudovitamin B12 is the predominant cobamide in Spirulina. J Agric Food Chem. DOI: 10.1021/jf990541b
- Watanabe F, Bito T. (2018). Vitamin B12 sources and microbial interaction. Exp Biol Med.
- O’Leary & Samman, 2010, Nutrients
- Hannibal et al., 2016, Front Mol Biosci
- https://ods.od.nih.gov/factsheets/VitaminB12-HealthProfessional/

